1. Температура гелия (молярная масса ![]() = 4 г/моль), распределение
молекул которого по скоростям можно считать
максвелловским, изменилась от Т1 = 200 К до Т2
= 400 К. Число молекул, скорости которых лежат в
интервале скоростей от V до V +
= 4 г/моль), распределение
молекул которого по скоростям можно считать
максвелловским, изменилась от Т1 = 200 К до Т2
= 400 К. Число молекул, скорости которых лежат в
интервале скоростей от V до V + ![]() V, осталось прежним. Определить скорость
этих молекул.
V, осталось прежним. Определить скорость
этих молекул.
2. Полагая распределение молекул азота
(молярная масса ![]() = 28
г/моль) по скоростям максвелловским, рассчитать
наивероятнейшую скорость поступательного
движения одной молекулы и среднюю полную энергию
всех молекул, занимающих при давлении Р = 2*105
Па и температуре t = 27°С объем V = 30 литров.
= 28
г/моль) по скоростям максвелловским, рассчитать
наивероятнейшую скорость поступательного
движения одной молекулы и среднюю полную энергию
всех молекул, занимающих при давлении Р = 2*105
Па и температуре t = 27°С объем V = 30 литров.
3. Идеальный газ (гелий), имеющий температуру Т,
находится внутри цилиндра высоты Н и радиуса r0.
Газ вместе с цилиндром вращается вокруг оси
цилиндра с угловой скоростью ![]() . Во сколько раз концентрация молекул у
стенок цилиндра превосходит их концентрацию на
расстоянии г = r0/2 от оси цилиндра?
. Во сколько раз концентрация молекул у
стенок цилиндра превосходит их концентрацию на
расстоянии г = r0/2 от оси цилиндра?
4. Оценить радиус г мелких шарообразных
частичек вещества, взвешенных в жидкости, если
при увеличении высоты на h = 13*10-3 мм
концентрация частичек вещества уменьшается в ![]() = 2 раза. Температура жидкости
t = 27°С, плотность жидкости r 1
= 0,9*103 кг/м3, плотность вещества
частичек r 2 = 1,2*103 кг/м3.
= 2 раза. Температура жидкости
t = 27°С, плотность жидкости r 1
= 0,9*103 кг/м3, плотность вещества
частичек r 2 = 1,2*103 кг/м3.
5. Сосуд, содержащий одноатомный идеальный газ
(молярная масс; ![]() = 4
г/моль), движется со скоростью U = 100 км/час.
Оценить, насколько возрастут средний квадрат
скорости теплового движения атомов и
температура газа при остановке сосуда.
Теплоемкостью и теплопроводностью стенок сосуда
можно пренебречь.
= 4
г/моль), движется со скоростью U = 100 км/час.
Оценить, насколько возрастут средний квадрат
скорости теплового движения атомов и
температура газа при остановке сосуда.
Теплоемкостью и теплопроводностью стенок сосуда
можно пренебречь.
6. Металлический чайник с водой нагревается на
газовой плите. Вода кипит и образуется пар с
постоянной скоростью выделения ![]() = 1,3*10-2 г/с. Удельная
теплота парообразования воды равна L = 2,25*106
Дж/кг. Дно чайника площадью S = 0,03 м2 покрыто
накипью толщиной l= 1 мм. Коэффициент
теплопроводности накипи
= 1,3*10-2 г/с. Удельная
теплота парообразования воды равна L = 2,25*106
Дж/кг. Дно чайника площадью S = 0,03 м2 покрыто
накипью толщиной l= 1 мм. Коэффициент
теплопроводности накипи ![]() =
1,25 Дж/(с*м*град). Считая теплопроводность металла,
из которого изготовлен чайник, значительно
больше теплопроводности накипи, оценить
разность
=
1,25 Дж/(с*м*град). Считая теплопроводность металла,
из которого изготовлен чайник, значительно
больше теплопроводности накипи, оценить
разность ![]() Т температур
между наружной поверхностью дна чайника и
поверхностью накипи, контактирующей с водой.
Т температур
между наружной поверхностью дна чайника и
поверхностью накипи, контактирующей с водой.
7. В сосуде при комнатной температуре находится
смесь идеальных газов: m1 = 4 кг одноатомного
неона и m2 = 1 кг двухатомного водорода.
Определить удельную теплоемкость смеси в
изохорическом процессе Сvm. Молярные массы
неона и водорода равны, соответственно, ![]() 1 = 20
г/моль, m 2 = 2 г/моль.
1 = 20
г/моль, m 2 = 2 г/моль.
8. Квазистатическое расширение идеального газа происходит по закону V = а Р-1/2, где а = const. Определить молярную теплоемкость газа в этом процессе, если его молярная теплоемкость при изохорическом процессе известна и равна Сv.
9. Идеальный газ находится в сосуде объемом V1 под давлением P1. Затем газ сжимают до объема V2 = V1/2 так, что его давление изменяется по закону Р ~ 1/V2. Определить работу газа в этом процессе.
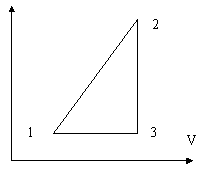 10. Определить
коэффициент полезного действия
10. Определить
коэффициент полезного действия ![]() тепловой машины, использующей в
качестве рабочего тела идеальный одноатомный
газ и работающей по обратимому циклу,
представленному на рисунке. Объемы и отношение
температур в 1-ом и 2-ом состояниях равны,
соответственно, V1 = 5 литров, V2 = 10
литров, Т2/T1 =
тепловой машины, использующей в
качестве рабочего тела идеальный одноатомный
газ и работающей по обратимому циклу,
представленному на рисунке. Объемы и отношение
температур в 1-ом и 2-ом состояниях равны,
соответственно, V1 = 5 литров, V2 = 10
литров, Т2/T1 = ![]() =
2,5.
=
2,5.
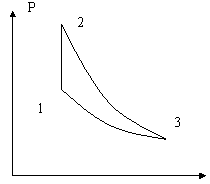 11. Тепловая машина с
идеальным газом в качестве рабочего вещества
совершает обратимый цикл, состоящий из изохоры
1-2, адиабаты 2-3 и изотермы 3-1 (см. рис). Определить
коэффициент полезного действия h
данной машины, как функцию максимальной Т2
и минимальной Т1 температур, достигаемых в
этом цикле.
11. Тепловая машина с
идеальным газом в качестве рабочего вещества
совершает обратимый цикл, состоящий из изохоры
1-2, адиабаты 2-3 и изотермы 3-1 (см. рис). Определить
коэффициент полезного действия h
данной машины, как функцию максимальной Т2
и минимальной Т1 температур, достигаемых в
этом цикле.
12. Идеальный газ в количестве n = 2 моля изотермически сжимают от объема V1, до объема V2 = V1/2. Найти изменение энтропии газа в этом процессе.
13. Теплоизолированный цилиндр разделен на две секции объемом V0 каждая невесомым поршнем, который может передвигаться без трения. Первоначально поршень закреплен, в одной секции цилиндра находится 1 моль идеального газа, а другая пуста. Затем поршень получает возможность свободно перемещаться, и происходит самопроизвольное необратимое расширение газа. Определить изменение температуры и энтропии после установления равновесного состояния.
14. Одинаковое количество молей ![]() 1 =
1 = ![]() 2 =
2 = ![]() = 50 молей водорода и кислорода
находятся в разных сосудах, имеющих одинаковые
объемы V1 = V2 = V = 20 литров. Оба газа
подчиняются уравнению Ван-дер-Ваальса, в котором
постоянные а для водорода и кислорода равны,
соответственно, а1(Н2) = 0,024 [м6*Па/моль2],
а2{О2) = 0,14 [м6* Па/моль2],
а постоянные b можно считать одинаковыми b1 =
b2. Определить, насколько будут отличаться
давления на стенки сосудов, содержащих водород и
кислород.
= 50 молей водорода и кислорода
находятся в разных сосудах, имеющих одинаковые
объемы V1 = V2 = V = 20 литров. Оба газа
подчиняются уравнению Ван-дер-Ваальса, в котором
постоянные а для водорода и кислорода равны,
соответственно, а1(Н2) = 0,024 [м6*Па/моль2],
а2{О2) = 0,14 [м6* Па/моль2],
а постоянные b можно считать одинаковыми b1 =
b2. Определить, насколько будут отличаться
давления на стенки сосудов, содержащих водород и
кислород.
15. Капилляр с запаянным верхним концом,
внутренние г = 0,44 мкм и длиной l = 30 см вертикально
опускают в широкий сосуд с жидкостью так, что
этот капилляр оказывается погруженным на
половину своей длины. При этом жидкость
поднимается в капилляре на высоту h. = 1/4 над ее
уровнем в сосуде. Жидкость полностью смачивает
стенки капилляра, ее плотность равна ![]() = 1,26 г/см3. Атмосферное
давление PA = 105 Па. Определить
коэффициент поверхностного натяжения s
жидкости.
= 1,26 г/см3. Атмосферное
давление PA = 105 Па. Определить
коэффициент поверхностного натяжения s
жидкости.
16. Определить теплоемкость идеального газа в процессе: P2V = const.
17. Пусть ![]() 0 -
отношение концентрации молекул водорода к
концентрации молекул азота вблизи поверхности
Земли, a
0 -
отношение концентрации молекул водорода к
концентрации молекул азота вблизи поверхности
Земли, a ![]() -
соответствующее отношение на высоте h = 3000 м.
Найти отношение
-
соответствующее отношение на высоте h = 3000 м.
Найти отношение ![]() /
/![]() 0 при Т = 280
К, полагая, что температура и ускорение
свободного падения не зависят от высоты. R = 8,3 Дж/моль*К.
0 при Т = 280
К, полагая, что температура и ускорение
свободного падения не зависят от высоты. R = 8,3 Дж/моль*К.
18. Молекулы идеального газа, у которого ![]() = 1,40 и давление P = 100
кПа, имеют среднюю энергию <
= 1,40 и давление P = 100
кПа, имеют среднюю энергию <![]() > = 2,5*10-20 Дж. Найти число молекул
в единице объема.
> = 2,5*10-20 Дж. Найти число молекул
в единице объема.
19. Вычислите количество теплоты, которое надо сообщить молю двухатомного идеального газа при его изобарическом обратимом нагревании, если а процессе нагрева газ совершил внешнюю работу в 20 Дж.
20. При какой температуре газа, состоящего из
смеси азота и кислорода, среднеквадратичные
скорости молекул азота и кислорода будут
отличаться друг от друга на ![]() V
= 30 м/с? Постоянная Больцмана k = 1,38*10-23 Дж/К.
V
= 30 м/с? Постоянная Больцмана k = 1,38*10-23 Дж/К.
21. Вычислить долю молекул идеального газа, имеющих модуль скорости в интервале от нуля до наивероятнейшей скорости.
22. Некоторая масса азота заключена в сосуде,
емкость которого 2 л. Температура азота 270С,
давление газа на стенки сосуда P = 13,3*10-5 Па. Определите, сколько
молекул азота содержится в сосуде, массу азота в
нем и внутреннюю энергию газа. R = 8,3 Дж/моль*К; ![]() = 1,4.
= 1,4.
23. В сосуде, объем которого V = 5 л, находится
кислород массой m = 4 г при температуре t = 130С.
Определите внутреннюю энергию газа и давление
газа на стенки сосуда. R = 8,3 Дж/моль*К; ![]() = 1,4.
= 1,4.
24. Найти приращение энтропии алюминиевого бруска массой m = 3,0 кг при нагревании его от T1 = 300 К до T2 = 600 К, если в этом интервале температур теплоемкость алюминия C = a + bT, где а = 0,77 Дж/{г*К), b = 0,46 мДж/(г*К2).
25. Гелий массой m = 1,7 г адиабатически расширили в п = 3,0 раза и затем изобарически сжали до первоначального объема. Найти приращение энтропии газа в этом процессе.
26. Идеальный газ с показателем адиабаты ![]() совершает прямой
цикл, состоящий из адиабаты, изобары и изохоры.
Найти КПД цикла, если при адиабатическом
процессе объем идеального газа увеличивается в п
раз.
совершает прямой
цикл, состоящий из адиабаты, изобары и изохоры.
Найти КПД цикла, если при адиабатическом
процессе объем идеального газа увеличивается в п
раз.
27. Один моль кислорода, находившегося при
температуре T0 = 290 K, адиабатически сжали
так, что его давление возросло в ![]() = 10 раз. Найти температуру газа
после сжатия и работу, которая была совершена над
газом.
= 10 раз. Найти температуру газа
после сжатия и работу, которая была совершена над
газом.
28. Найти относительное число молекул идеального газа, скорости которых отличаются от средней не более чем на 1 %.
29. Теплоизолированный сосуд разделен
перегородкой на две большие части так, что объем
одной из них в п = 2,0 раза больше объема
другой. В меньшей части находится ![]() 1 = 0,30 моля азота, а в большей части
1 = 0,30 моля азота, а в большей части ![]() 2 = 0,70 моля кислорода.
Температуры газов одинаковые. В перегородке
открыли отверстие и газы перемешались. Найти
приращение энтропии системы, считая газы
идеальными.
2 = 0,70 моля кислорода.
Температуры газов одинаковые. В перегородке
открыли отверстие и газы перемешались. Найти
приращение энтропии системы, считая газы
идеальными.
30. В двух сосудах объемом V1 = 5 л и V2 = 7 л находится воздух под давлением P1 = 2 атм и P2 = 1 атм. Температура в обоих сосудах одинаковая. Какое давление установится, если сосуды соединить между собой? Температура воздуха не меняется.